|  |  |  |  |
ATOMKUNSKAP
 |  |

Bild: Pontus Wallstedt / UgglansNO ©
Atomen består av en kärna med protoner (positivt laddade) och neutroner (neutralt laddade). Runt atomkärnan finns elektroner (negativt laddade) i olika elektronskal. Antalet protoner bestämmer vilket grundämne det är. Elektronerna i det yttersta elektronskalet (valenselektroner) bestämmer grundämnets egenskaper.
Bild: geralt / Pixabay License
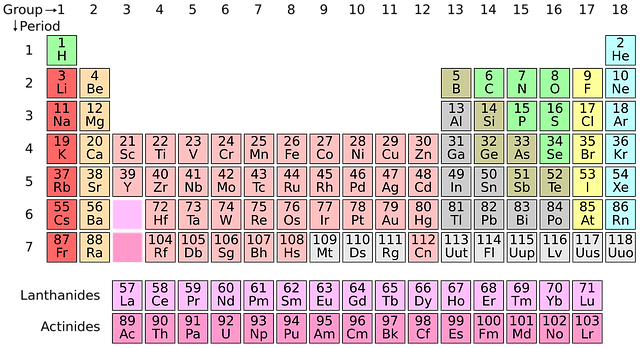
I det periodiska systemet finns alla grundämnen som är kända idag. Som grundämne, uppställt i periodiska systemet, har det alltid lika många elektroner som protoner. Ett grundämne är alltså oladdat. Grundämnen eftersträvar fullt yttre elektronskal. Därför ger/tar eller lånar de elektroner med andra atomer. Om en atom inte har lika många protoner (positiva laddningar) som elektroner (negativa laddningar) kallas den jon. En atom blir en positiv jon om den har förlorat elektroner och en negativ jon om den har tagit upp elektroner.
Bild: OskarUggla / UgglansNO ©
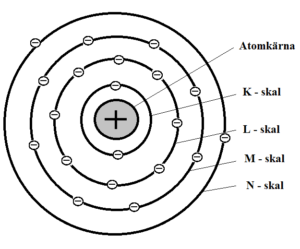
Elektronskal är de energinivåer som elektronerna färdas i. Skalen börjar namnges från atomkärnan med bokstaven K. K-skalet kan max innehålla två elektroner, L-skalet åtta. Det yttersta elektronskalet kan max innehålla åtta elektroner oavsett vilken bokstav det har (undantag om det är K-skalet).
Sammanfattning: Antalet protoner avgör vilket grundämne det är. Antalet elektroner bestämmer om grundämnet är en jon (laddat) eller oladdat. Antalet neutroner avgör vilken isotop av grundämnet det är. En isotop är en variant av ett grundämne. Alla grundämnen har isotoper. Isotoperna av ett grundämne får olika egenskaper. Framförallt avgör det om ämnet är radioaktivt eller inte.
Fördjupning:
- Film – Atomen (Andreas Sandqvist, 9.58, Svenska)
- Film – Atomnummer, masstal och atommassa (Magnus Ehinger, 11.57, svenska)
- Film – Atomens byggnad (Bertram Stenlund, Svenska, 5,04)
- Hemsida – Atomer (naturvetenskap.org)
- Film – Atoms explained (Kurzgesagt, 4.58, Engelska)
- Film – Niels Bohr (Urplay, 18.00, svenska)
Uppgifter:
PERIODISKA SYSTEMET
 |  |
Redan under forntiden var vissa grundämnen kända. Det var de som kunde hittas i naturen eller som enkelt kunde framställas till exempel guld, silver, koppar, järn och tenn.
Under historiens gång har hela tiden upptäckter av nya grundämnen gjorts, framför allt under 1700-talet och 1800-talet. På mitten av 1800-talet skapade ryssen Dmitrij Mendelejev ett system för hur grundämnena var besläktade med varandra. Detta gjorde han innan atommodellen och protonen var upptäckta.
Bild: geralt / Pixabay License
Han kallade sin modell för det periodiska systemet. I hans periodiska system fanns det många tomma rutor för grundämnen som ännu inte upptäckts. Mendelejev kunde, förutom att förutsäga att det fanns oupptäckta grundämnen, även förutsäga dessa grundämnens egenskaper. Idag är de upptäckta och hans förutsägelser stämde.
Det periodiska systemet är indelat i perioder och grupper. En vågrät rad kallas period.
Dessa grundämnen har samma antal elektronskal.
En kolumn (lodrät) kallas grupp. Dessa grundämnen har samma antal valenselektroner d.v.s. lika många elektroner i sitt yttersta skal. Det är endast valenselektronerna som påverkas vid en kemisk reaktion. I en grupp har grundämnena liknande egenskaper (undantag väte). Därför brukar grundämnen i en grupp kallas grundämnesfamiljer.
De flesta grundämnen som finns är metaller (ungefär 95 st). De finns till vänster och i mitten av det periodiska systemet. Ickemetallerna (18 st) finns till höger (undantag väte) och några få halvmetaller (7 st) finns emellan dessa.
Fördjupning:
- Film – Periodiska systemet (Andreas Sandqvist, 6.51, Svenska)
- Film – Grupper och perioder (Magnus Ehinger, 8.23, svenska)
- Hemsida – Periodiska systemet (org)
- Film – The periodic table song(AsapSCIENCE, engelska, 2.53)
- Film – The genius of Mendeleev´s periodic table (TED-ED, engelska, 4.24)
Uppgifter:
GRUNDÄMNESFAMILJER
 |  |
Grundämnen som är i samma grupp i det periodiska systemet har liknande egenskaper. De har samma antal valenselektroner.
Alkalimetaller

Alkalimetaller har en kraftig reaktion med vatten. Vätgas bildas och lösningen blir basisk (pH över 7). Alkalimetaller reagerar också snabbt med luftens syre och måste förvaras i fotogen. I periodiska systemet finns alkalimetallerna (grupp 1) längst till vänster.

Bild: OskarUggla / UgglansNO ©
Anledningen till alkalimetallernas reaktionsförmåga är att de alla har en valenselektron. Den vill de gärna bli av med och därför uppstår de kraftiga kemiska reaktionerna. Alkalimetaller med högre atomnummer reagerar kraftigare eftersom då är valenselektronen längre från kärnan och kan enklare reagera.
Halogener

Bild: OskarUggla / UgglansNO ©
Kallas saltbildare eftersom de är väldigt bra på att bilda salter. Halogener är också väldigt reaktiva. Allra bäst på att reagera med andra ämnen är fluor. De är alla ickemetaller. Alla halogener har sju valenselektroner. I periodiska systemet finns halogenerna (grupp 17) näst längst till höger.
Ädelgaser

Bild: Jim Nelson / CC BY-NC-SA 2.0
Dessa grundämnen har maxantalet elektroner i sitt yttersta elektronskal (två eller åtta). Det kallas ädelgasstruktur. Det innebär att de oftast inte vill reagera med andra ämnen. Därför finns det alltid ädelgas inuti glödlampor. Glödtråden får ingen chans att reagera med luftens syre och brinna upp. I periodiska systemet finns ädelgaserna (grupp 18) längst till höger.
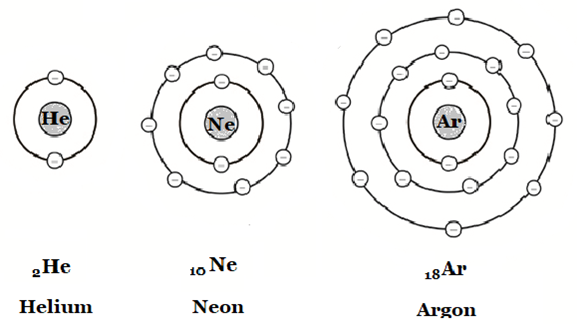
Bild: OskarUggla / UgglansNO ©
Fördjupning:
- Hemsida – Alkalimetall, Halogener, Ädelgaser (Wikipedia)
- Film – Alkalimetaller och halogener (Magnus Ehinger, 9.59, svenska)
- Film – Ädelgaser (Magnus Ehinger, 4.13, svenska)
- Film – Brainiac Alkali metals (scientist303, engelska, 3.16).
- Film – Alkali metals in water (ironnica, engelska, 2.21).
- Film –– The Halogens (Jon Dicks: Group 7, engelska, 4,.35)
- Film – Noble gases (Fuseschool, engelska, 4.11)
Uppgifter:
METALLBINDNINGAR
 |  |
Alla atomer eftersträvar ett fullt yttersta elektronskal. Om ett ämne har fullt i yttersta elektronskalet kallas det att ämnet har ädelgasstruktur. Ädelgaser har redan från början ädelgasstruktur och är därför ovilliga att reagera med andra ämnen.
Bild: Artturi_Mantysaari / Pixabay License
Det finns tre olika strategier för att uppnå ädelgasstruktur: att atomerna delar på elektronerna gemensamt (på två olika sätt) eller att de tar och ger elektroner mellan varandra.
Beroende på atomernas bindning döps den kemiska föreningen olika.
- Metallbindning → metaller
- Molekylbindning → molekyler
- Jonbindning → salter
Till exempel i vatten hålls atomerna ihop med hjälp av en molekylbindning. Alltså är det korrekt att säga vattenmolekyl. Vanligt bordssalt, natriumklorid, är inte en molekyl utan ett salt.
En kemisk förening är ett övergripande ord som innebär att två eller fler grundämnen sitter ihop. Det går inte att kalla rena metaller för kemiska föreningar men många molekyler och alla salter är kemiska föreningar.
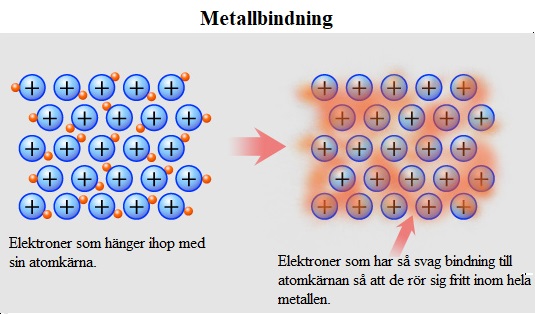
Metallbindningar
Metaller leder elektricitet och värme och därför måste det finnas rörliga laddningar inuti metallen. Dessa rörliga laddningar beror på att varje metallatom släpper ifrån sig sina valenselektroner och har dem gemensamt i ett elektronmoln. Alla metallatomer får då ädelgasstruktur.
Bild: Julen Aduriz EHU / CC BY-SA 4.0
Alla rena metaller har metallbindning och denna bindningstypen är stark. Det krävs generellt höga temperaturer för att få metaller att övergå till flytande form eller till gasform.
Bild: Pavlofox / Pixabay License
Fördjupning:
- Film –What are metallic bonds? (Fuseschool: engelska, 4.13)
- Film – Metallbindningar (Urplay, 2.01, svenska)
- Film – Metallbindningar (Magnus Ehinger, 7.58, svenska)
- Film – How atoms bond (Ted-Ed, 3.34, Engelska)
Uppgifter:
MOLEKYLBINDNINGAR
 |  |
Molekylbindning kallas också kovalent bindning eller elektronparbindning.
Vid molekylbindning delar atomen på en eller flera elektroner för att uppnå ädelgasstruktur. Hos grundämnen som har gasform vid rumstemperatur är det vanligt att dela på elektroner till exempel syre, kväve, väte, fluor och klor. Atomerna sitter då ihop två och två.
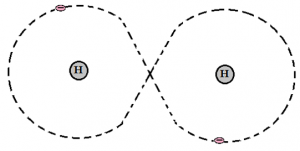
Bild: OskarUggla / UgglansNO ©
I exemplet ovan med väte nedan har atomkärnorna en proton. Varje väteatom har en valenselektron. Dessa två elektroner går runt båda atomkärnorna. Det innebär att båda väteatomerna får fullt yttersta skal eftersom de har elektronerna gemensamt. K-skalet är fullt med två elektroner. Detta kallas molekylbindning.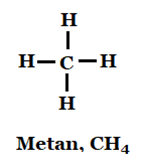
När atomer har molekylbindning är det alltid bara valenselektronerna som berörs. I den organiska kemin binds alltid atomerna ihop med molekylbindning. Vanligtvis visas bindningarna med streck. Varje streck motsvaras av två valenselektroner d.v.s. en molekylbindning. Vätet har en valenselektron och kolet har fyra.
Bild: OskarUggla / UgglansNO ©
Anledningen till att kolet har fyra streck eller fyra molekylbindningar är att den får då fullt yttre skal. Kolet lånar en elektron från fyra väteatomer och har fyra själv: 1+1+1+1+4 = 8.
Vätet lånar en valenselektron. 1+1 = 2. Alla atomer får ädelgasstruktur. Tänk på att alla elektroner är utmålade men det är bara valenselektronerna som är en del av molekylbindningen.
Nedan är en bild på koldioxid vars atomer också har molekylbindning. Syre har sex valenselektroner och kol har fyra. Därför har kol och syre två elektroner var som åker i båda grundämnenas elektronbanor. Kolet gör detta på båda syreatomerna. Alla får då fulla elektronskal. På bilden nedan ser du hur konstruktionen ser ut.
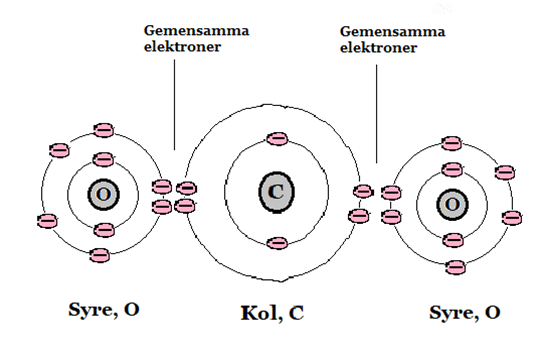
Bild: OskarUggla / UgglansNO ©
Fördjupning:
- Hemsida – Molekyler (org)
- Film – Kovalent bindning (Magnus Ehinger, 15.59, svenska)
- Film – Covalent bonding (Fuseschool, engelska, 3.24)
Uppgifter:
JONBINDNING
 |  |
En jon är en atom som gett bort eller som tagit upp en eller flera elektroner för att uppnå fullt yttersta elektronskal.
Jonbindning är en bindning mellan två joner. För att en kemisk förening med jonbindning ska kunna bildas krävs det att en atom vill ge bort elektroner och att en annan atom vill ta upp dem. Den kemiska föreningen kallas för salt.
Den atom som ger bort elektroner blir en positiv jon och den atom som tar upp elektroner blir en negativ jon. Jonföreningar bildas oftast av grundämnen som står långt ifrån varandra i periodiska systemet.
Jonföreningar är vanligtvis sammansatta av en positiv jon och en negativ jon. De kan också bestå av en positiv jon och en negativ jon som består av flera sammansatta grundämnen.
Ta upp eller ge bort elektroner?
Vi börjar att titta på alkalimetallerna (gr. 1) som har en valenselektron. Om en alkalimetall blir av med den får den då fullt yttersta elektronskal (eftersom K-skalet, som blir kvar, innehåller två elektroner och då är det fullt.)

Bild: OskarUggla / UgglansNO ©
Om alkalimetallen blir av med en elektron försvinner en minusladdning. Den får fler positiva protoner än negativa elektroner. Alltså blir alkalimetaller positiva som joner. Samtliga alkalimetaller får laddningen 1+ som joner. Lägg de positiva och negativa laddningarna i en gammaldags våg så ser du att de positiva väger mest. Det blir överskott med en plusladdning.
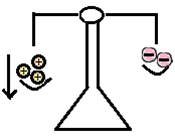
Bild: OskarUggla / UgglansNO ©
Grundämnena i grupp 2 har två valenselektroner. För att få ett fullt yttersta elektronskal behöva den ge bort dem. Då får atomen ett överskott på två plusladdningar. Därför får grundämnena i grupp två jonladdningen 2+.
Halogenerna (gr. 17) saknar en valenselektron för att uppnå fullt yttersta skal. De har sju men vill ha åtta valenselektroner. De tar upp en elektron någonstans ifrån för att uppnå fullt yttersta elektronskal. Ofta sker det vid en kemisk reaktion till exempel när ett salt bildas. När halogener gör detta får de fler negativa elektroner än positiva protoner. Halogener blir alltså negativa som joner. Samtliga halogener får laddningen 1- som joner.

Bild: OskarUggla / UgglansNO ©
- Grundämnena i grupp 16: till exempel syre, svavel. Saknar två valenselektroner och får oftast jonladdningen 2–.
- Grundämnena i grupp 13 har jonladdningen 3+och de i grupp 15 har jonladdningen 3–.
Övriga grundämnen är det svårt att lista ut jonladdningen på. Du får slå upp dem i en tabell.
Fördjupning:
- Film – Joner (Andreas Sandqvist, svenska, 7.27)
- Film – Jonbindningar (Urplay, 1.51, svenska)
- Film – Jonbindningar och jonföreningars egenskaper (Magnus Ehinger, 7.02, svenska)
- Film – Jonbindningar (Magnus Ehinger, svenska, 5.46)
- Film – Hur blir atomen en jon? (Studi, svenska, 4.03)
- Hemsida – Joner (org)
Uppgifter:
ATT BILDA SALTER
 |  |
Positiva och negativa joner dras till varandra och ordnar in sig i en speciell ordning som kallas kristall eller kristallstruktur. Det kallar vi salt. I ett salt så finns det lika många negativa laddningar som positiva laddningar.
Den positiva jonen är oftast en metall och den negativa jonen är oftast en ickemetall. Metallatomen lämnar elektroner (kan vara flera som lämnas) till ickemetallen. Nedan är en bild på hur jonerna ordnar in sig i detta mönster i vanligt bordssalt.
 |  |
Formelskrivning med salter
Innan du börjar skriva en kemisk formel behöver du veta vilken jonladdning ämnena har. Det ser du i det periodiska systemet eller i en tabell.
Att tänka på:
- I en kemisk förening skrivs alltid den positiva jonen först.
- Den kemiska föreningen som bildas ska vara elektriskt neutral.
Natrium reagerar med klor och bildar natriumklorid. Så här skriver du reaktionsformeln:
Så här kan det se ut med en bild:

Bild: OskarUggla / UgglansNO ©
Exempel 2: Litiumdisulfid. Så här skriver du reaktionsformeln:
Denna kemiska förening kallas Dilitiumsulfid eller bara Litiumsulfid. Observera den lilla tvåan efter Li som betyder att det är två stycken litiumatomer. Tvåan har olika position före och efter reaktionen.
Exempel 3: Kalcium reagerar med fluor. Så här skriver du reaktionsformeln:
De flesta salter kan lösas i vatten. Vattnets kemiska egenskaper delar upp saltet vilket gör att de positiva och negativa jonerna flyter fritt omkring i vattnet. Det kallas för en jonlösning och på grund av jonerna leder jonlösningen elektricitet.
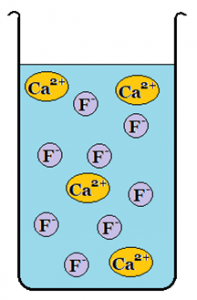
Bild: OskarUggla / UgglansNO ©
Om vattnet inte kan lösa upp saltet kallas det för ett svårlösligt salt.
Den negativa jonen kan bestå av flera sammansatta grundämnen. Sammansatta negativa joner sitter hårt ihop med molekylbindningar och går inte isär även om de blandas med vatten. I en sådan jonlösning finns det positiva joner och sammansatta negativa joner.
Exempel på negativa sammansatta joner:

När du skriver kemiska formler med sammansatta joner är det enklast att bara se laddningen och tänka sig att den negativa jonen sitter ihop och inte delar sig. Om det, i en kemisk förening, krävs fler negativa joner för att det ska bli en neutral laddning sätter du den sammansatta jonen i en parentes och markerar antal negativa joner till höger om parentesen.
2 SO4 = (SO4)2
Exempel 4: Magnesium reagerar med nitrat. Så här skriver du reaktionsformeln:
Saltet i tabellen heter magnesiumdinitrat.
Bild: alusruvi / Pixabay License
Fördjupning:
- Film – Salter (Andreas Sandqvist, 9.55, Svenska)
- Film – Hur jonföreningar bildas (Magnus Ehinger, 9.50, svenska)
- Hemsida – Salter (org)
- Hemsida – Salter (pluggno.se)
- Hemsida – Jonföreningars formler (kursnavet.se)
Uppgifter:
VÄRLDSBERÖMDA SALTER
 |  |
En kristall är en slags struktur då atomerna i ett ämne är regelbundet ordnade, helt eller delvis. Salter, som inte är i vattenlösningar, är i kristallstruktur. Här följer några vanliga salter:
Natriumklorid, NaCl
Bild: Oskar Uggla / UgglansNO
Kallas också koksalt och är helt nödvändigt för kroppen. För lite eller för mycket salt i maten kan vara ohälsosamt. Detta salt användes förr ofta till att förlänga matens hållbarhet.
Natriumvätekarbonat, NaHCO3
Bild: Oskar Uggla / UgglansNO
Mer känt som bikarbonat och finns i bakpulver. Det finns också i pulverbrandssläckare då mycket koldioxid utvecklas och släcker branden.
Kalciumkarbonat, CaCO3
Kalksten är ett vanligt samlingsnamn för flera karbonater. Kalciumkarbonat används i byggnadsmaterial som betong och cement. Skelett, tänder och skal på olika blötdjur är också uppbyggda av detta salt.
Kalciumsulfat, CaSO4
Bild: Istock
Mer känt som gips. Vanligt som byggnadsmaterial och för att stabilisera brutna armar och ben.
Ammoniumklorid, NH4Cl
Bild: nataliaaggiato / Pixabay License
Ett annat namn är salmiak som finns i godis. Det är också en beståndsdel i batterier som inte går att ladda upp.
Kaliumnitrat, KNO3
Bild: By Photo: Myrabella / CC BY-SA 3.0
Detta salt innehåller en stor del syre och är därför en beståndsdel i svartkrut. Idag används det för att få iväg fyrverkerier.
Kopparsulfat, CuSO4
Bild: Oskar Uggla / UgglansNO
Väldigt giftigt och miljöfarligt. Används för att få bort mördarsniglar från trädgården.
Fördjupning:
- Film – Jonföreningarnas namn (Magnus Ehinger, 12.04, svenska)
- Film – How do crystals work? (Ted-Ed, 5.07, Engelska)
- Hemsida – wikipedia: salter
Uppgifter:
ANALYSERA JONER
 |  |

Bild: Pontus Wallstedt / UgglansNO ©
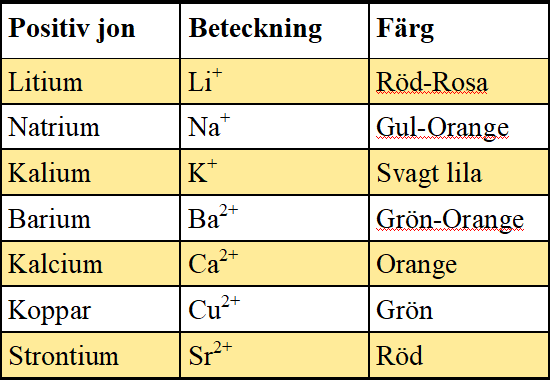
Kemi kan vara ett detektivarbete. Att analysera och avslöja salters positiva och negativa joner är inga problem. Men för att ta reda på positiva och negativa joner används två helt olika strategier.
Positiva joner
När vissa positiva joner utsätts för hög temperatur avger de synligt ljus i olika färger (våglängd). Därför används salter i fyrverkerier och bengaliska eldar. Det är de positiva jonerna som ger färgen. De negativa jonerna ger inga synliga färger så de påverkar inte resultatet. För att undersöka de positiva jonerna i ett salt tar du lite salt och strör över en låga. Lågan från metan brinner med en blå låga utan några gula eller orangea flammor. Därför är metan perfekt till denna undersökning.
Negativa joner
För att undersöka negativa joner behövs olika typer av reagens. En reagens är ett ämne som på något sätt reagerar med det som ska testas så att du kan avgöra vilket ämne det är.

Om du har en jonlösning med ett okänt salt kan du pröva att hälla i ett annat salt. När två olika salter (lösta i vatten) blandas i samma bägare kan det ibland bildas en fällning. En fällning är ett svårlösligt salt som vattnet inte kan dela på. En fällning kan se olika ut och ha olika färg. Ofta är fällningen vit och gör vattnet grumligt.
Bild: OskarUggla / UgglansNO
Salter med positiva och negativa joner som har samma storlek och/eller har samma värde på sin jonladdning kan vara svårlösliga. Exempel på svårlösliga salter är silverklorid och bariumsulfat.
På bilden nedan visas lågprov (från vänster) koppar, natrium och strontium.
Bild: Jonathan Sanderson / CC BY-NC-SA 2.0
Fördjupning:
- Hemsida – Att identifiera ett okänt salt (naturvetenskap.org)
- Film – Flame test (Kimberly Stites Megalab, engelska, 4.48)
Uppgifter:
JONER: SYROR OCH BASER
 |  |
Syror och baser är jonlösningar. Flera baser är fasta ämnen som behöver spädas för att bli en jonlösning.
Kort repetition om syror och baser:
pH-skalan mäter hur surt eller basiskt något är. En neutral lösning har pH 7. Lösningar under pH 7 är sura och över pH 7 är basiska. För varje steg på skalan ökar/minskar surheten med gånger 10.
Baser och syror delas upp i starka och svaga baser respektive syror. I starka syror delas alla molekyler upp i joner när de löses med vatten och frigör många vätejoner, H+. Svaga syror delas bara delvis upp till joner vid kontakt med vatten. Samma sak gäller även baser med skillnaden att de frigör hydroxidjoner OH–. Det är stor skillnad i pH mellan svaga och starka syror/baser.
Neutralisation – Blandar du en syra med en bas kommer du att få en neutralisation, d.v.s. att pH-värdet närmar sig 7.
De starka syrornas joner är:
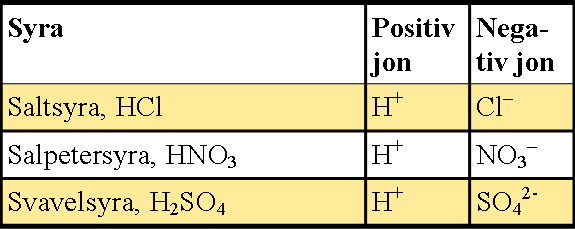
Det är vätejonen, H+ som gör något surt. Ju fler vätejoner, desto lägre pH. På bilden syns hur saltsyra delat upp sig. Det kallas protolys när vätejonen lämnar syran.

Bild: Oskar Uggla / UgglansNO©
I bägaren finns också många vattenmolekyler.
De starka basernas joner är:
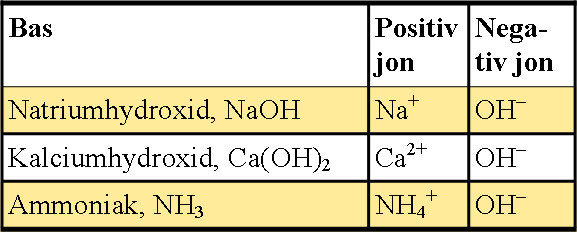
Det är hydroxidjonen, OH–, som gör något basiskt. Ju fler hydroxidjoner, desto högre pH.
Syror kan användas för att skapa salter.
Här är två exempel:
1) Om en syra och en bas blandas kommer vätejonen och hydroxidjonen reagera och bilda vatten. pH-värdet kommer att närma sig 7. Detta kallas neutralisation. Det kommer också att bildas ett salt:
Syra + Bas → Vatten + Salt.
HCl + NaOH → H20 +NaCl (koksalt)
2) Syror löser upp oädla metaller. Hälls syra över en metall bildas vätgas och ett salt.
Syra + Metall → Väte + Salt
2 HCl + Mg → H2 + MgCl2

Bild: Pontus Wallstedt / UgglansNO©
Fördjupning:
- Film – Syror och baser del 1 (Andreas Sandqvist, 10.35, Svenska)
- Film – Syror och baser del 2 (Andreas Sandqvist, 11.27, Svenska)
- Film – Syror och baser del 3 (Andreas Sandqvist, 15.12, Svenska)
- Film – Acids and bases (Ted-Ed, 3.48, Engelska)
- Musik – H2SO4 det blir svavelsyra
- Film – Syror och baser (brom8305, svenska, 13.00)
Uppgifter:
 |  |  |  |  |